Cáncer de mama
"La supervivencia del cáncer de mama ha aumentado por la mejoría en el diagnóstico precoz y en las terapias aplicadas contra esta patología".
DRA. ISABEL RUBIO RODRÍGUEZ
COORDINADORA. ÁREA DE CÁNCER DE MAMA

¿Qué es el cáncer de mama?
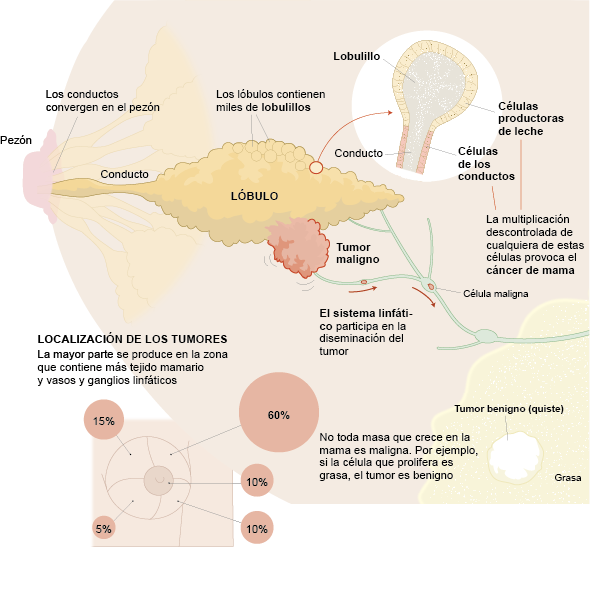
El cáncer de mama es una enfermedad de la glándula mamaria que ocurre cuando las células crecen y se multiplican de forma anormal. Como resultado, crecen descontroladamente y forman el tumor. Es el cáncer más frecuente en mujeres, aunque también puede afectar a hombres.
En la Clínica Universidad de Navarra la paciente que acude con algún síntoma es diagnosticada por uno de nuestros expertos y obtiene un plan de tratamiento personalizado que puede comenzar tan sólo en una semana desde la finalización de las pruebas.
El Área de Cáncer de Mama de la Clínica Universidad de Navarra dispone de la tecnología más avanzada para el diagnóstico y tratamiento del cáncer de mama. Aproximadamente, el 90-95% del cáncer de mama se produce de manera esporádica. Es decir, aparece por alteraciones en los genes, además de otros factores de riesgo, pero no es heredado.
Aproximadamente entre un 5 y un 10% de los casos de cáncer de mama son hereditarios. Esto significa que se deben a una alteración (mutación) en un gen que puede haberse heredado del padre o de la madre. En la Clínica, le realizaremos las pruebas necesarias para saber si su cáncer es esporádico (sin relación hereditaria) o si está relacionado con una predisposición genética.
Si fuera necesario, tendrá una consulta con la Unidad de Medicina Genómica, donde especialistas en consejo genético le explicarán de forma clara y detallada todo lo relacionado con estos genes y lo que significan para usted y su familia.
Contacte con nosotros y le ayudaremos para ofrecerle la mejor solución

Síntomas del cáncer de mama
Es fundamental acudir a un especialista en patología mamaria si nota alguno de los siguientes síntomas:
- Un bulto o una zona engrosada en la mama o en la axila (debajo del brazo).
- Cambios en el tamaño, la forma o el aspecto de la mama: Cualquier asimetría o alteración que no sea habitual merece atención.
- Retracción, eccema o hundimiento del pezón: Estas modificaciones pueden estar relacionadas con condiciones subyacentes graves.
- Secreción de sangre u otro líquido por el pezón: Aunque no siempre indica cáncer, es un síntoma que debe evaluarse.
- Cambios en la piel, como enrojecimiento, descamación o una textura que recuerda a la piel de naranja.
- Dolor persistente en la mama: Aunque el dolor mamario suele asociarse con afecciones benignas, también puede ser un signo de cáncer de mama.
- Inflamación parcial o total del seno, aunque no esté acompañada de un bulto visible.
Recuerde que la detección temprana es clave para el tratamiento exitoso del cáncer de mama. Ante cualquier cambio sospechoso, busque atención médica sin demora.
¿Tiene alguno de estos síntomas?
Si sospecha que padece alguno de los síntomas mencionados,
debe acudir para su diagnóstico a un especialista médico.
¿Cuáles son las causas?
La causas que producen el cáncer de mama son multifactoriales, es decir, no se pueden atribuir a un solo factor. Entre estos factores se encuentran:
- Edad. Aumenta el riesgo con la edad. La mayor incidencia de cáncer de mama se sitúa entre los 50 y los 60 años.
- Antecedentes familiares de cáncer de mama. En función del número de familiares afectos y la relación, si estos son de primer o segundo grado, y la edad de aparición, hay diferentes riesgos de desarrollarlo.
- Factores hereditarios. Aproximadamente entre el 5 y el 10% de los casos son hereditarios. La mitad de estos casos se atribuyen a la mutación de dos genes: BRCA1 y BRCA2. En estos casos es recomendable hacer un estudio genético.
- Tener el primer embarazo después de los 30 años o no tener hijos.
- Una menstruación precoz (antes de los 12 años) y una menopausia tardía (después de los 55).
- Determinadas lesiones benignas en la mama, sobre todo lesiones proliferativas con atipia.
- Estilo de vida: consumo de alcohol, obesidad, fumar y la inactividad física.
Más de la mitad de las mujeres que padecen cáncer de mama no presentan ninguno de estos factores de riesgo, ni todas las mujeres que cuentan con uno o más factores de riesgo llegan a desarrollarlo. Por este motivo cobran especial importancia los sistemas de detección precoz.
¿Qué tipos de cáncer de mama hay?
Existen varios tipos de cáncer de mama, que se clasifican según su origen (ductal o lobulillar), su comportamiento (invasivo o no invasivo), y sus características moleculares (receptores hormonales y proteínas específicas).
El 95% se originan en el epitelio de los conductos o lóbulos mamarios (el tejido que recubre internamente los conductos que transportan la leche). Según su localización, pueden ser ductales, lobulillares o, si afectan al complejo areola-pezón, se conocen como Enfermedad de Paget.
Menos del 1% tiene origen mesenquimal, es decir, provienen de tejidos como el conectivo, vascular o muscular de la mama. Estos casos se denominan sarcomas, como los tumores phyllodes malignos o el angiosarcoma.
Las características moleculares del tumor se determinan mediante biomarcadores como los receptores de estrógeno, progesterona, Her2 o Ki-67. Estos permiten seleccionar tratamientos personalizados, adaptados a las características del tumor, del paciente y a sus preferencias.
La decisión del tratamiento se toma siempre de forma compartida entre el equipo médico y el paciente.
¿Se puede heredar el cáncer de mama?
En aproximadamente un 15–20% de los casos de cáncer de mama existe una historia familiar de la enfermedad, sin que se identifique una mutación genética heredada. En estos casos, el riesgo se debe probablemente a factores genéticos aún no conocidos y a la combinación con otros factores de riesgo.
En cambio, el cáncer de mama hereditario se produce por una mutación genética identificable, siendo los genes BRCA1 y BRCA2 los más frecuentes. Estas mutaciones también se asocian a otros tipos de cáncer y pueden transmitirse a los hijos con una probabilidad del 50%.
Ser portador sano de una mutación genética no significa que se desarrollará cáncer, pero el riesgo de padecerlo es significativamente mayor que en personas sin la mutación.
¿Qué riesgo tengo de tener un cáncer de mama?
En la Clínica Universidad de Navarra, disponemos de una Consulta de Valoración de Riesgo de Cáncer de Mama en la que, tras analizar los antecedentes familiares y personales, así como las características mamarias de la paciente, se emplea un programa informático para determinar aproximadamente el riesgo de cáncer de mama y recomendar las pruebas radiológicas más adecuadas para un diagnóstico precoz.
Si tiene una lesión en la mama que aumenta el riesgo de tener un cáncer de mama, nuestros especialistas le explicarán la mejor manera de hacer el seguimiento.
¿Cómo se diagnostica el cáncer de mama?
Una de las claves del éxito a la hora de tratar el cáncer de mama es la valoración integral por parte de todos los especialistas que forman parte del proceso y la rapidez en establecer la mejor pauta de tratamiento.
Por ello, la Clínica Universidad de Navarra cuenta con un área médica específica para el diagnóstico y tratamiento del cáncer de mama, compuesta por un equipo multidisciplinar de profesionales especializados en cáncer de mama.
Le realizarán la historia clínica, la exploración física y se añadirán métodos de imagen como:
- Mamografía
- Ecografía mamaria
- Resonancia magnética o mamografía de contraste
- Biopsia mamaria - con aguja gruesa o de vacío
¿Cómo se trata el cáncer de mama?
Tumorectomía de mama
La tumorectomía o cirugía conservadora de mama es el tratamiento quirúrgico indicado en el 70–80% de los casos de cáncer de mama. Consiste en extirpar únicamente el tumor, conservando el resto del tejido mamario. Se ha demostrado que tiene los mismos resultados oncológicos que la mastectomía, y además mejora la calidad de vida de las pacientes, según numerosos estudios.
En la mayoría de los casos requiere una hospitalización de 24 horas, aunque en algunas situaciones puede realizarse de forma ambulatoria. Siempre que sea posible, se opta por cicatrices ocultas (como en el borde de la areola, el surco submamario o la axila) o por técnicas de cirugía oncoplástica, que combinan oncología y cirugía plástica para obtener el mejor resultado estético.
Estas técnicas permiten extirpar el tumor con márgenes adecuados y remodelar la mama para que el resultado estético sea lo mejor posible, reduciendo así la necesidad de mastectomías.
Además, la supervivencia con cirugía conservadora combinada con radioterapia es equivalente a la obtenida con mastectomía.
En la Clínica Universidad de Navarra, nuestros cirujanos son pioneros expertos en el uso de ecografía intraoperatoria, lo que mejora la precisión quirúrgica en tumores no palpables y reduce el riesgo de márgenes positivos.
Mastectomía
En el 20–30% de los casos, la extirpación completa de la mama (mastectomía) es necesaria. Existen varias técnicas según el caso clínico:
- Mastectomía simple: se extirpa todo el tejido mamario, incluida la piel y el complejo areola-pezón. Requiere hospitalización de 1 a 2 días y puede combinarse con otros tratamientos.
- Mastectomía radical modificada: se extirpa el tejido mamario, el complejo areola-pezón y los ganglios linfáticos de la axila. También requiere 1–2 días de ingreso y puede incluir reconstrucción inmediata.
- Mastectomía con preservación de piel: se conserva la piel de la mama, pero se retira el complejo areola-pezón. Mejora el resultado estético en la reconstrucción.
- Mastectomía con preservación de piel y complejo areola-pezón: se conserva toda la piel y el complejo areola-pezón. Ofrece un resultado más natural tras la reconstrucción. Para aplicarla, se realiza un estudio previo con mamografía, resonancia magnética y biopsia del pezón para confirmar que no hay afectación tumoral.
En la Clinica de Navarra, realizamos la reconstrucción mamaria en el 90% de los casos tras la mastectomía , garantizando un abordaje integral que mejora la calidad de vida y los resultados estéticos para nuestras pacientes. En caso de que la paciente requiera radioterapia posterior a la mastectomia también valoramos la reconstrucción inmediata y hasta un 60% de las pacientes con radioterapia posterior reciben reconstrucción inmediata.
La radioterapia postoperatoria es un paso clave para reducir el riesgo de que el tumor reaparezca en la zona operada. De hecho, está demostrado que disminuye ese riesgo a aproximadamente una tercera parte.
En la Clínica Universidad de Navarra contamos con amplia experiencia tanto en radioterapia convencional (irradiando toda la mama durante 6 semanas) como en radioterapia parcial (irradiando solo la zona donde estaba el tumor, llamada lecho tumoral, durante solo 5 días).
En casos de tumores de mama en estadio inicial, la radioterapia parcial, dirigida únicamente a la zona de mayor riesgo, ofrece resultados muy satisfactorios, con un riesgo mínimo de recaída.
La Clínica Universidad de Navarra ha puesto en marcha distintas técnicas de irradiación parcial de la mama:
Braquiterapia de mama de alta tasa perioperatoria
- Procedimiento mínimamente invasivo que permite administrar la radiación directamente en el lecho tumoral, justo durante la cirugía de extirpación.
- Reduce la duración del tratamiento de 6 semanas a solo 5 días.
- Al finalizar, los catéteres se retiran de forma sencilla en la consulta, sin anestesia.
- Somos centro de referencia internacional y el que cuenta con mayor experiencia acreditada en esta técnica.
Braquiterapia de mama de alta tasa perioperatoria + radioterapia externa con técnica "forward"
- Indicada cuando el cáncer está más extendido.
- Se combina la braquiterapia en la zona de mayor riesgo con radioterapia externa sobre el resto del tejido mamario, para asegurar un tratamiento completo.
Radioterapia externa con técnica "forward"
- Permite una administración más homogénea de la radiación que la técnica convencional, reduciendo efectos secundarios agudos.
- Acorta el tratamiento a 15 sesiones, frente a las 25 de la radioterapia tradicional.
Radioterapia externa parcial con técnica acelerada
- Irradia únicamente el lecho tumoral, sin tratar toda la mama.
- Utilizamos un esquema acelerado de 5 días, concentrando la dosis total en menos tiempo y evitando tratamientos prolongados de varias semanas.
La elección del tratamiento de quimioterapia más adecuado depende de varios factores:
- Tamaño del tumor.
- Afectación de los ganglios linfáticos.
- Presencia o no de metástasis a distancia.
- Tratamientos previos recibidos.
- Subtipo de cáncer de mama (según la presencia de receptores de estrógenos, progesterona, HER2, etc.).
- Edad y estado general de salud.
- Otras enfermedades asociadas (comorbilidades).
- Posibles efectos secundarios del tratamiento.
En general, la quimioterapia en el cáncer de mama se puede administrar en tres contextos:
Adyuvante (después de la cirugía)
- Se utiliza en tumores localizados para reforzar el tratamiento local.
- Su objetivo es eliminar posibles células tumorales que circulen por la sangre o pequeñas metástasis no detectadas, reduciendo así el riesgo de recaída.
Neoadyuvante (antes de la cirugía)
- Permite iniciar antes el tratamiento sistémico.
- Ayuda a evaluar si el tumor responde a la quimioterapia (si disminuye su tamaño).
- Puede reducir el volumen del tumor, lo que facilita realizar una cirugía más conservadora o hacer operables tumores que inicialmente no lo eran.
En enfermedad avanzada o diseminada
- Se emplea para controlar las metástasis y frenar la progresión de la enfermedad, mejorando la calidad de vida.
En la Clínica Universidad de Navarra contamos con protocolos específicos y amplia experiencia en la administración de quimioterapia en mujeres embarazadas con cáncer de mama, siempre con la máxima seguridad para madre y bebé.
Disponemos de una amplia gama de fármacos quimioterápicos para adaptar el tratamiento a cada tipo de tumor y situación clínica.
El tratamiento hormonal, también llamado terapia endocrina, es una estrategia fundamental para tratar los tumores de mama que tienen receptores hormonales positivos (HR+), es decir, aquellos que crecen estimulados por hormonas como el estrógeno (ER) y/o la progesterona (PR).
Este tipo de tumores son los más frecuentes: representan entre el 70% y el 80% de todos los cánceres de mama.
En los últimos años, el tratamiento hormonal del cáncer de mama hormonosensible (HR+) ha evolucionado de forma importante, tanto en fases iniciales como en enfermedad avanzada, gracias a nuevos medicamentos y a un enfoque más personalizado según las características biológicas del tumor.
Está demostrado que la terapia hormonal reduce el riesgo de recaída y mejora la supervivencia en pacientes con este tipo de cáncer.
Moduladores selectivos de los receptores de estrógenos (SERM)
- Ejemplo: Tamoxifeno.
- Bloquea la acción de los estrógenos en las células tumorales, impidiendo su crecimiento.
Inhibidores de la aromatasa
- Ejemplos: Anastrozol, Letrozol, Exemestano.
- Reducen la cantidad de estrógenos que produce el organismo, limitando así el estímulo hormonal sobre el tumor.
Análogos de LHRH (hormona liberadora de gonadotropinas)
- Ejemplos: Goserelina, Triptorelina.
- Bloquean la producción de estrógenos en los ovarios, siendo útiles especialmente en mujeres premenopáusicas.
SERDs (Selective Estrogen Receptor Degraders o degradadores selectivos del receptor de estrógeno)
- Ejemplos: Fulvestrant, Camizestrant, Elacestrant.
- No solo bloquean la acción de los estrógenos, sino que además destruyen el receptor de estrógeno en la célula tumoral.
- Actualmente aprobados para cáncer de mama avanzado o metastásico, y en estudio para fases iniciales.
Otros medicamentos asociados: Inhibidores de CDK4/6
- Ejemplos: Palbociclib, Ribociclib, Abemaciclib.
- Se utilizan en tumores con receptores hormonales positivos y HER2 negativo, en enfermedad avanzada o metastásica.
- Las CDK4 y CDK6 son proteínas que controlan el ciclo celular, es decir, el proceso por el que las células crecen y se dividen.
- Estos fármacos bloquean esa división celular y suelen administrarse junto con terapia hormonal como letrozol, anastrozol, fulvestrant o tamoxifeno.
- Han supuesto un gran avance en el tratamiento, prolongando el control de la enfermedad.
El sistema inmunitario es clave en la defensa frente al cáncer. La inmunoterapia busca estimular o “reentrenar” las defensas naturales de la paciente para que sea su propio organismo el que reconozca y ataque las células tumorales.
En el cáncer de mama, la inmunoterapia ha adquirido un papel importante, especialmente en subtipos agresivos como el cáncer de mama triple negativo (TNBC), que no presenta receptores hormonales ni HER2 y donde las opciones de tratamiento convencionales son más limitadas.
Cómo funciona
Una de las estrategias más empleadas son los inhibidores de puntos de control inmunológico (anticuerpos anti-PD-1 y anti-PD-L1).
- Estos fármacos actúan “quitando los frenos” del sistema inmunitario, permitiendo que las defensas ataquen mejor al tumor.
- En combinación con quimioterapia, han demostrado mejorar la supervivencia y el control de la enfermedad en pacientes con cáncer de mama avanzado o metastásico.
Vacunas personalizadas contra el cáncer de mama
En la Clínica Universidad de Navarra también se aplican vacunas individualizadas dentro de protocolos de inmunoterapia:
- Se elaboran con células de la propia paciente (vacunas autólogas), evitando el riesgo de rechazo.
- Se obtienen los antígenos (marcadores únicos) del tumor para que el sistema inmunitario lo identifique y lo ataque.
- Se administran junto con quimioterapia, sobre todo en casos de enfermedad localizada que requieren este tratamiento.
Ventajas
- Buena tolerancia al ser un producto del propio organismo.
- Tratamiento individualizado y compatible con quimioterapia.
- Puede mantenerse durante un tiempo prolongado, especialmente en los primeros 5 años tras el diagnóstico, cuando el riesgo de recaída es mayor.
Cómo se producen
- Las células se extraen de la paciente y se procesan en el laboratorio GMP de Terapia Celular de la Clínica.
- A partir de ellas se obtienen los antígenos tumorales que se incorporan a la vacuna.
- El tratamiento se administra según un calendario vacunal de dos años como complemento al tratamiento oncológico estándar.
Investigación y uso actual
La Clínica ha realizado un ensayo clínico para evaluar la eficacia de estas vacunas en un subgrupo de cáncer de mama sin expresión de la proteína HER2.
Actualmente, las ofrecemos como tratamiento compasivo para complementar las terapias habituales.
En algunos casos de cáncer de mama, las células tumorales producen en exceso una proteína llamada HER2 (receptor 2 del factor de crecimiento epidérmico humano). Esta proteína estimula el crecimiento del tumor de forma más rápida y agresiva.
Aproximadamente entre el 10% y el 20% de los cánceres de mama presentan esta sobreexpresión de HER2.
Para este tipo de tumores existen tratamientos específicos con inhibidores del receptor HER2, que han demostrado ser muy eficaces cuando se combinan con quimioterapia, logrando:
- Mayor respuesta del tumor al tratamiento.
- Prolongación de la supervivencia.
En la Clínica Universidad de Navarra seguimos investigando nuevas terapias con el objetivo de aumentar la eficacia y reducir los efectos secundarios de estos tratamientos.
Anticuerpos conjugados a fármacos (ADC)
Los ADC (Antibody-Drug Conjugates, por sus siglas en inglés) representan una de las estrategias más innovadoras para el tratamiento de cáncer de mama, especialmente en tumores HER2 positivos o triple negativos.
Cómo funcionan:
- Combinan un anticuerpo monoclonal (que reconoce una proteína específica de la célula tumoral, como HER2 o Trop-2) con un fármaco quimioterápico muy potente.
- El anticuerpo actúa como “misil dirigido”, uniéndose únicamente a las células cancerosas que expresan esa proteína.
- Una vez unido, libera el fármaco directamente dentro del tumor, destruyendo las células malignas y reduciendo el daño a los tejidos sanos.
Ventajas:
- Mayor precisión en el ataque al tumor.
- Menos toxicidad general que la quimioterapia convencional.
- Mejoras demostradas en supervivencia y calidad de vida en pacientes con cáncer de mama avanzado o metastásico.
Actualmente, ya existen ADC aprobados para el tratamiento del cáncer de mama, y muchos otros están en fases avanzadas de investigación.

UNA MEDICINA PERSONALIZADA
Segunda Opinión,
la tranquilidad de saber
Solicite una Segunda Opinión de nuestros profesionales con gran experiencia en el diagnóstico y tratamientos de enfermedades oncológicas
En 3 días, sin moverse de casa.
O si lo prefiere puede acudir a la Clínica.
Por qué elegir a la Clínica Universidad de Navarra
LOS TRATAMIENTOS MÁS VANGUARDISTAS
Cirugía Oncoplástica y
Reconstrucción de la Mama
Nuestros cirujanos están especializados en la planificación quirúrgica para conservar la mayor cantidad de tejido mamario sano y, si es necesario, la reconstrucción mamaria de manera inmediata.
- Cirugía oncoplástica conservadora.
- Mastectomía conservando areola-pezón.
- Ecografía intraoperatoria.
- Prevención de los ganglios axilares.
- Reconstrucción inmediata de la mama.
Terapias dirigidas e Inmunoterapia contra el cáncer de mama
Contamos con una gran experiencia en la administración de las terapias más innovadoras, como las vacunas dendríticas que complementan el tratamiento estándar.
- Tratamientos basados en inmunoterapia.
- Vacunas contra el cáncer de mama.
Irradiación parcial
acelerada
Pioneros en España en irradiación parcial acelerada con braquiterapia, reduciendo la administración de radioterapia a cinco días, en lugar de los veinticinco días habituales.
- Braquiterapia intersticial.
- Braquiterapia intraoperatoria.
- Radioterapia intraoperatoria.
- Técnicas innovadoras de radioterapia (Terapia de Protones).
Protonterapia contra el cáncer
La terapia con protones es la modalidad de radioterapia externa de mayor precisión, que aporta mejor distribución de la dosis de radiación y, por tanto, menor irradiación de los tejidos sanos.
La Unidad de Protonterapia o de Terapia de Protones del Cancer Center Clínica Universidad de Navarra en su sede de Madrid es la más avanzada de Europa y la primera en un Centro de Cáncer, con todo su apoyo asistencial, académico e investigador.
¿Qué ensayos clínicos tenemos sobre Cáncer de mama?
Nuestro equipo de profesionales
Ayudamos a nuestros pacientes a superar sus historias
Sus testimonios nos animan para seguir mejorando nuestros servicios